特集:医薬品の信頼と安心を届ける〜中外製薬の徹底した医薬安全性の追求〜
中外製薬は、バイオ医薬品や分子標的治療薬など、革新的な医薬品を世界中に提供しています。新規作用メカニズムを有するこれらの医薬品は、効果が高い半面、予期しない副作用などが発現する場合もあり“諸刃の剣”になる可能性があります。そのため中外製薬では、患者さんに安心して適正に使用していただくことを目的に、経営に直結した「医薬安全性本部」を設置し、安全性専門のチームを配置し安全性監視体制を万全にすることで、医薬品のより適正な使用を推進し、患者さんや医療機関に信頼される企業となることを目指しています。
バイオ・新規抗がん剤の徹底した安全性評価で業界をリードしています。
抗がん剤やバイオ医薬品などの革新的新薬では、承認取得後、多くの場合「全例調査」を実施します。「全例調査」では、薬剤を使用する医療機関とすべての患者さんを登録し、製品使用前に卸売企業・調剤薬局に対し事前説明するほか、医療機関・処方医の専門性や、副作用が発生した際の処置が可能であるかを確認するなど、患者さんの使用状況および安全性モニタリング、適正使用の推進を広範囲に徹底して実施してきました。中外製薬は「アバスチン®」「タルセバ®」「アクテムラ®」といった生物学的製剤で、かつ新規作用メカニズムを有した抗がん製品に関する大規模な「全例調査」を他社に先駆けて取り組んできました。これらの調査経験と膨大なデータの解析を積み重ね、その結果を学会発表や文献にすることで、現在では業界をリードする存在にまでなっています。
また、調査が義務づけられていなくても必要性があれば、調査に準じた安全性監視計画を自ら実行しています。これらは多くのリソースを費やしますが、私たちには医薬品の安全性を確保し、患者さんの治療を安全かつ適切なものにしていく使命があります。
中外製薬は、日本の製薬会社ではトップレベルである年間約10万件の安全性情報を収集しており、医学的見地から質の高い評価を実施しています。その評価結果はグローバルデータベースに登録し、医療機関はもとより、日本・欧米・アジアの各当局にスピーディに発信・開示しています。情報の量もさることながら、安全性評価の実施にあたっては、臨床経験が豊富な医師資格を有する社員を安全性本部に専任に配置し、専門的医学評価が行える体制を整えています。
さらに、医薬品の安全性を確保していくためには、「疫学的観点」に基づく安全性情報のデータ分析能力の強化が不可欠です。中外製薬では、疫学機能を担う専門グループを設置し分析精度の向上に努めてきたほか、日本の疫学データベースの充実に貢献していくべく、専門企業などとの連携を積極的に図っています。
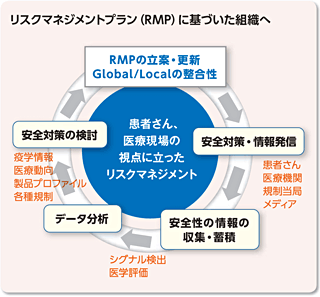
会社のコミットメントとして医薬品リスクマネジメントプランを作成・発信していきます。
ファーマコビジランス(医薬品安全性監視)とは、医薬品の副作用または医薬品に関連するその他の問題の検出・評価・理解・予防に関する科学と活動のことですが、近年、その重要性の認識が急速に高まり、これまでになく世界的に活動が活発化し、それに伴い制度は厳格化しています。特に、患者支援活動などで得られた情報を含めたより広範囲に安全性情報を収集すること、グローバルレベルでの統一した安全性管理体制を整備すること、そして、医療機関や患者さんとの直接的なコミュニケーションの推進によって透明性を高めることなどが求められています。
こうした中、中外製薬では、ファーマコビジランス活動の立案・実施・検証のサイクルの実現に向け、また海外の新しい薬事制度に準拠するため、グローバル基準の安全管理体制を一層強化しました。その成果の一つとして、当社は2012年から、他社に先駆け5品目において「医薬品リスク管理計画(RMP:Risk Management Plan)」を策定し、すでに運用を開始しています。RMPの策定・運用は、日本では2013年4月から法令上義務づけられましたが、中外製薬が積極的に運用を開始したのは、医薬品は有効性と副作用のバランスで成り立つものであり、副作用の監視方法やリスク最小化のための方法を「リスクマネジメントプラン」として企業が策定し、それを理解していただくことで医薬品をより適正に使用してもらうようにすることが、患者さんや医療機関への「当社の約束」と肝に銘じているからです。さらに、中外製薬は、その信念に基づいて、シグナル検出体制の確立、高い専門性を持った評価、安全確保措置の迅速決定など、さまざまな取り組みを進めていきます。
グローバル基準で安全性情報をお届けしています。
中外製薬は、国内外の安全性情報の評価やその周知について統一を図り、新しいグローバル基準に合わせるため、ロシュとの連携の強みを活かしています。最近では、新しい薬事制度に準拠するために、他のパートナー会社との間でファーマコビジランスに関する取り決めを刷新し、相互のコミュニケーション方法を詳細かつ具体的に定め、円滑な運用を進めています。また、製品ごとに安全性評価の基準も統一し、副作用情報を共有するとともに、安全性対策や対応方法についても、ロシュとの連携のもと、グローバルで迅速に意思決定していく体制を確立しています。
加えて、製品ごとの固有の副作用については、発現のリスク因子と考えられる情報や典型例などをまとめ、患者さん向けに冊子を配布するほか、中外製薬ウェブサイトにて情報公開を行い、一方では医療機関に向けてはMR が担当施設毎に個別にフィードバックを実施しています。こうした活動により、副作用発現リスクの高い患者さんに配慮した治療が行われる環境を整え、副作用の発現例数の低下や重篤化の低減に着実につなげています。それは、情報は抱えているだけでは意味がなく、積極的に発信・公開しなければ、患者さんや医療機関にとって、本当に意味のある活動にならないからです。
中外製薬の取り組みは、新しい薬事制度に応じて発信するものではなく、医療現場において医薬品の使用方法を適切にし、患者さんの治療をよりよいものにしたいとの想いから、自らが考え推進するものです。これからも、真に価値あるデータを迅速に、的確に届け、世界の医療に貢献していくことを目指します。

医薬品業界において、安全性への取り組みがこれだけ注目された時代はかつてなかったと思います。国境を越えた安全性の対応が厳格に求められており、製品開発のより早期から市販後の患者さんの安全性確保を見据えた対応が必要です。さらに、高い透明性とともに信頼を得るためには、患者さんや医療機関とのコミュニケーションの充実が必須となっていると、強く感じております。
医薬品は「効果と副作用」のバランスで成り立っていること考えると、副作用としてのリスクを的確に捉え、想定範囲としそのリスクマネジメントを予め備えておくことが、患者さんの薬物治療においては大変重要であります。そのことによって、製品として医薬品の最大価値を患者さんに届けることができると思いますし、それが我々の存在意義の根幹をなす取り組みでもあります。中外製薬では、これまでの医薬品で発生したさまざまな事象や経験を力に変えて、医療機関、患者さんへの説明責任を果たすべく「安全性」に関する取り組みに全力注いでいます。
そのすべてに共通しているのは、当局基準に応えるだけでなく、安全性を確保するために、本当に必要な基準は何であるかを自ら考え、妥協なく我々が取り組んできたことにあります。そして、安全性確保の取り組みを自社の活動にとどまらず、業界、医療機関まで広げていく。そして、患者さんの治療に本当に意味のある医薬品の情報を、適切に、的確に、タイムリーに発信していきたい。それこそが業界のリーダたる中外製薬の使命であると考えています。
医薬安全性本部長 大箸 義章

